物質を構成する粒子には、原子・イオン・分子がある。これらの粒子が集まって物質となる。
1)原子の構造
原子は原子核と電子から構成されている。原子核はさらに陽子と中性子からできている。陽子は電気的に正(+)に、電子は負(-)に荷電した粒子で、中性子は±0の粒子である。原子は原子核を中心として、電子はその周りに陽子の数と同じだけ存在する。つまり、原子全体では電気的に中性である。

また、原子核に含まれる陽子の数は、それぞれの元素に固有のものである。つまり、陽子の数によって、その原子が何原子なのかが分かる。そこで、この陽子の数をその原子の原子番号と呼ぶ。その他、陽子数と中性子数の和はその原子の重さを決定する(電子は陽子・中性子に比べてかなり軽いさいので無視できる)ので、その原子の質量数という。これを表すときは、元素記号の左上に質量数を、左下に原子番号をつけて表す。

2)電子配置
原子の構造は陽子と中性子からなる原子核を中心として、そのまわりに電子が存在していた。この電子はいくつかの層に分かれて存在している。この層を電子殻という。電子殻は原子核から近いものからK殻,L殻,M殻,・・・と呼ばれている。
1つの電子殻に入りうる電子の最大数は決まっている。内側の電子殻からK,L,M,・・・となるが、これをn=1,2,3,・・・と対応させた場合、それぞれの電子殻には最大で2n2個の電子が入る。
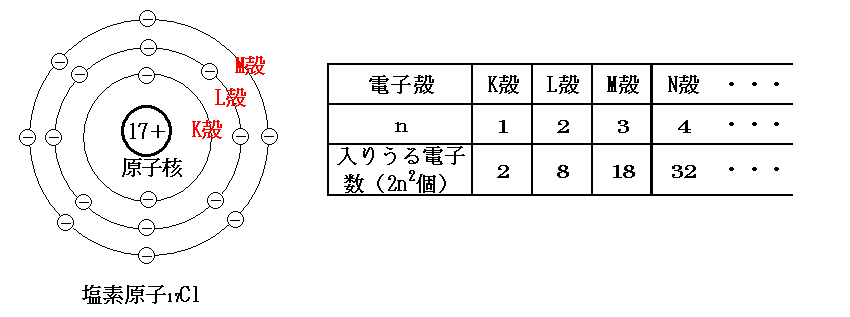
次に原子番号1~20の原子の電子配置を見てみる(下表)。

・K殻には電子は2個まで入るので、1Hと2HeにはK殻しか存在しない。・3Li~10NeはK殻に2個の電子が入り、これでK殻がいっぱいになるので、残りはL殻へ入っていく。・11Na以降はL殻が電子8個までしか入らないので、さらに外側の電子殻へと入っていく。
ここで、M殻は最大で電子が18個まで入るが19Kと20CaはM殻に8個電子が入って残りはN殻に入っている。これは、この状態が安定なためで、このように電子は電子殻の容量を満たさないまま次の殻に入っていくこともある(18Arまでは普通に考えてよい)。また、最大の電子数で満たされている電子殻を閉殻といい、閉殻の状態の電子殻は安定である。
希ガス元素の電子配置
周期表の最も右側の縦の並びである18族(2He,10Ne,18Ar,36Cr,56Xe,86Rn)は希ガスといわれ、化学的に非常に安定で、他の原子と反応したりすることはほとんどない。これらの原子の電子配置には共通の特徴が見られる。

上に希ガス元素の電子配置を示した。これを見ると、He以外は最外殻電子が全て8個である。Heの場合K殻(最大で電子を2個収容)なので8にはならない。希ガス元素は化学的に安定という事実から、最外殻電子が8個という条件が化学的安定につながるといえる。この最外殻の電子が8個の状態をオクテッドという。
ポイント:安定な電子配置
最外殻電子が8個の状態(K殻しかないものは2個)
3)価電子
原子が他の原子と反応するときは最外殻の電子が関与する。内側の殻の電子は外側の殻に覆われた形になるので、内側の殻の電子は反応にはほとんど関与しない。そのため最外殻の電子がその原子の性質を示すことになる。この最外殻の電子をその原子の価電子という。最外殻電子の数が1~7のときは、そのまま価電子数1~7という。しかし最外殻電子が8(K殻しかないものは2)の場合は先に説明したように、ほとんど反応しないので、荷電子数は0(ゼロ)とする。また、周期表上で同じ族(縦の並び)の原子は価電子が同じになる。
問題
1、解答例にならって、次の原子の電子配置をかけ。 解答例 K2,L8,M1
9F, 12Mg, 16S, 18Ar
順に、K2,L7 K2,L8,M2 K2,L8,M6 K2,L8,M8
2、次の図は原子の電子配置を示したものである。これについて次の問いに答えよ。

(1) (ウ)の原子番号はいくらか。 (2) 化学結合をしにくいものはどれか。
(3)同じ族に含まれるのはどれとどれか。
(1)原子番号=陽子数=電子数だから 8。
(2)化学結合しにくいものは最外殻電子が8(K殻しかないものは2)のもの。(ア)と(エ)
(3)同族(周期表で同じ縦の並び)の元素は最外殻電子数が等しい。この組み合わせはこの問題に場合、存在しないが、(ア)と(エ)はともに希ガス元素の原子である。(ア)がK殻しかないため、最外殻電子数は合わないが、同族である。
4)イオンの電子配置(イオンの生成)
原子は最外殻電子が8個(K殻しかないものは2個)の状態が最も安定であった。ということは、最外殻電子が8個(K殻しかないものは2個)でないものは安定な状態になろうとする。そこで原子は自身が持っている電子を放出(捨てる)したり、逆に足りない分を受け取ったりして、最外殻電子が8個の状態になる。この状態をイオンという。電子はマイナスの粒子なので、電子を受け取った場合は、陰イオン(マイナスイオン)、放出した場合は、陽イオン(プラスイオン)になる。
最外殻電子1~3の原子 → 最外殻電子を放出し、一つ内側の電子殻で8になり、安定化。・・・陽イオンの生成
最外殻電子6~7の原子 → 足りない電子を受け取って、その電子殻で8になり、安定化。・・・陰イオンの生成
最外殻電子4~5の原子 → イオンにならない。別の方法で安定化する。

イオンの化学式をイオン式という。+,-は元素記号の右上に付ける。電子を1個放出した場合+,2個では2+,3個では3+と表記する。電子を1個受け取った場合は-,2個では2-と表記する。+,2+,3+をそれぞれ1価,2価,3価の陽イオンといい、-,2-,3-をそれぞれ1価,2価,3価の陰イオンという。
イオンの電子配置は必ず希ガス元素の電子配置と同じになる。また、F-,Mg2+のように原子1つからできているイオンを単原子イオンという。
陽イオンになるのは金属元素、陰イオンになるのは非金属元素である。 注意:水素Hは特別。 非金属だがH+となる(H-にもなる)。
問題 次のイオンの電子配置をかき,また同じ電子配置をもつ希ガスの原子の名前をいえ。
(ア)Li+ (イ)Cl- (ウ)S2- (エ)Ca2+
まず、イオンになる前の原子の状態の電子配置を考えて、そこから、イオンの電子配置にする。
(ア)Liは3Liなので、電子配置は K2,L1 である。Li+は最外殻の電子を1つ放出したイオンなので、 K2,L1 つまり、K2
(イ)Clは17Clなので、電子配置は K2,L8,M7 である。Cl-は最外殻に電子を1つ受け取ったイオンなので、K2,L8,M7+1 つまり、K2,L8,M8
以降同様に考えると、 (ウ)K2,L8,M6+2 より、K2,L8,M8 (エ)K2,L8,M8,N2 より、K2,L8,M8
また、同じ電子配置をもつ希ガスは、それぞれのイオンの電子数と同じ電子数の希ガスを答えればよい。
(ア)ヘリウム (イ)アルゴン (ウ)アルゴン (エ)アルゴン
5)多原子イオン
2つ以上の原子でできているイオンを多原子イオンという。
例1 水酸化物イオン OH- → O原子1個とH原子1個が結合し、さらに電子1つを受け取った形。全体で-1
電子の数は O原子の電子数8 + H原子の電子数1 + 受け取った電子数1 = 10個
例2 アンモニウムイオン NH4+ → N原子1個とH原子4個が結合し、さらに電子1つを放出した形。全体で+1
電子の数は N原子の電子数7 + H原子の電子数1×4 - 放出した電子数1 = 10個
6)イオン結合とイオン結晶
陰イオンと陽イオンは、電気的な力(静電気力またはクーロン力という)によって結合する。これをイオン結合という。また、イオン結合によって、生じる結晶がイオン結晶である。
結晶の構成粒子の配列を示したものを結晶格子といい、その最小単位を単位格子という。塩化ナトリウム型と塩化セシウム型がある。

粒子の計算例: 塩化ナトリウム型の場合
Cl-
|
各頂点(8カ所)に |
1 |
個,各面の中心(6カ所)に |
1 |
個。 |
|
8 |
2 |
|
計 8× |
1 |
+ 6× |
1 |
= 4個 |
|
8 |
2 |
Na+
|
各辺の中心(12カ所)に |
1 |
個,立方体の中心に1個。 |
|
4 |
|
計 12× |
1 |
+ 1= 4個 |
|
4 |
配位数の例: 塩化ナトリウム型の場合
立方体の中心にある粒子(この場合はCl-)に着目する。この粒子から最も近い原子を数える。下の図で、立方体の中心である●から最も近 いのは○の6個。

7)共有結合と共有結晶
共有結合と電子式
①電子式 ・・・ 最外殻電子を「・」で元素記号のまわり(上下左右)に添付した式
例) 炭素C,水素H,窒素N,酸素O,塩素Cl,ケイ素Si,硫黄S,フッ素F
|
元素名 |
原子番号 |
電子配置 |
最外殻電子 |
電子式 |
|
水素H |
1 |
K1 |
1 |
|
|
炭素C |
6 |
K2 L4 |
4 |
|
|
窒素N |
7 |
K2 L5 |
5 |
|
|
酸素O |
8 |
K2 L6 |
6 |
|
|
フッ素F |
9 |
K2 L7 |
7 |
|
|
ケイ素Si |
14 |
K2 L8 M4 |
4 |
|
|
硫黄S |
16 |
K2 L8 M6 |
6 |
|
|
塩素Cl |
17 |
K2 L8 M7 |
7 |
②電子対と不対電子
電子は2個で対をつくり、対になったものを電子対という。また1個で存在する電子を不対電子という。

③共有結合 ・・・ 非金属元素どうしの結合
金属元素と非金属元素の結合では、それぞれ陽イオン,陰イオンとなって安定化し、静電気力により結合(イオン結合)した。では、非金属元素どうしでは、陰イオンどうしは反発し合うので、結合できない。非金属元素どうしは、別の方法で安定化し結合する。この結合は、互いの不対電子を共有し合って、互いに安定化(最外殻電子8、ただしK殻しかないものは2に)することによって結合する。この結合を共有結合という。

問題 水H2O,二酸化炭素CO2,窒素N2を電子式で表せ。
共有結合と分子
共有結合によってできた物質を分子という ・・・ 分子は非金属元素どうしで構成される
分子の表し方
|
物質名 |
分子式 |
構成原子の電子式 |
分子の電子式 |
構造式 |
分子の形 |
|
水 |
H2O |
折れ線 |
|||
|
メタン |
CH4 |
正四面体 |
|||
|
二酸化炭素 |
CO2 |
直線 |
|||
|
窒素 |
N2 |
直線 |
|||
|
アンモニア |
NH3 |
三角錐 |
8)配位結合と錯イオン
配位結合
アンモニウムイオンNH4+とオキソニウムイオンH3O+について考える。
NH4+:アンモニアNH3分子に水素イオンH+が結合した形。
H3O+:水H2O分子にH+が結合した形。
これを電子式で考えると次のようになる。

NH3には非共有電子対がある。H+はHが電子を放出して陽イオンになっているので、空の電子殻を持っている。共有結合は、2つの原子がそれぞれの不対電子を出し合って、それを互いに共有するが、この場合NH3が持っている非共有電子対をH+が共有させてもらう形で結合する。また、結合してしまえば、どのHも同じであるので、全体で+になる)。H3O+の場合も同様の原理でH2OにH+が結合している。このように一方が持っている非共有電子対に、電子をもっていない他方が結合する共有結合を配位結合という。
NH4+やH3O+を配位結合していることを表すために次のように示すことがある。

イオン
金属の陽イオンが分子やイオンがもつ非共有電子対に配位結合したものを錯イオンという。
↓
配位子という。NH3,H2O,OH-,CN-,Cl-などがある
例)[Ag(NH3)2]+ 銀イオンAg+がアンモニア分子2つに配位結合している。
錯イオンについての補足
①配位数
金属イオンに配位する配位子の数を配位数といい、金属イオンの種類にのよりほぼ決まっている。
|
金属イオン |
Ag+ |
Zn2+ |
Cu2+ |
Fe2+ |
Fe3+ |
Co3+ |
|
配位数 |
2 |
4 |
4 |
6 |
6 |
6 |
②電荷数 錯イオンの電荷数は、金属イオンと配位子の電荷の和になる。
例:[Cu(NH3)4]2+ → Cu2+=+2, NH3=0 ・・・ +2+0×4=+2
③錯イオンの形・・・錯イオンの形は、その配位数によって次のような形をとる。
直線型(2配位),正方形(4配位),正四面体(4配位),正八面体(6配位)

④錯イオンの名称
錯イオンの名称は、(配位数)・(配位子名)・(中心金属名)・(金属イオンの酸化数)の順で呼び、最後にイオン(陽イオンのとき)または酸イオン(陰イオンのとき)をつける。
配位数 → モノ(1),ジ(2),トリ(3),テトラ(4),ペンタ(5),ヘキサ(6)
配位子名→ NH3(アンミン),CN-(シアノ),Cl-(クロロ),H2O(アクア),OH-(ヒドロキソ)
例:[Ag(NH3)2]+ ジアンミン銀(Ⅰ)イオン [Cu(NH3)4]2+ テトラアンミン銅(Ⅱ)イオン[Fe(CN)6]4- ヘキサシアノ鉄(Ⅱ)酸イオン [Fe(CN)6]3- ヘキサシアノ鉄(Ⅲ)酸イオン
9)分子の極性
電気陰性度
原子には電子を引きつける力がある。この強さを表す尺度を電気陰性度という。陰イオンになりやすい元素(素非金属元素:周期表では右寄り)の方が大きい。最外殻が原子核に近い元素(周期表では上)の方が大きい。
☆周期表上では希ガス(18族:最も右側)を除いて右上にある原子ほど大きくなる。希ガス元素は安定な元素で、他の原子と結合することはないので希ガスの電気陰性度は求められていない。
極性
異種原子間の共有結合では共有電子対は電気陰性度の大きい元素の原子の方に偏って存在する。結合で電子に偏りがあることを、結合に極性があるという。極性の大きさは、原子間の電気陰性度の差に比例する。よくでてくる元素の電気陰性度の大きさは、F > O > N = Cl > C > Hである。
極性分子
分子全体で見たときに電子の偏りがあるものを極性分子という。例 HCl 極性分子 CH4 無極性分子

☆ δ(デルタ)は電子の偏りを表し、δ-の方に電子が偏っている。 → は電子の偏りの向きを表す。分子全体でベクトルの和が0になる分子は無極性分子となる。
問題 次の分子は極性分子か無極性分子か。 ① Cl2 ② CO2 ③ NH3 ④ H2O
各分子の形から、分子全体ベクトルを考えて判断する。
①同一の原子の結合だから、極性は生じない。無極性。 ②直線だから、ベクトルの和は0になるので無極性
③三角錐で、ベクトルの和は0にならないので、極性 ④折れ線で、ベクトルの和は0にならないので、極性
10)共有結晶
多数の原子が全て共有結合によって連なり、規則正しく配列している結晶を共有結晶という。炭素の単体,ケイ素の単体,二酸化ケイ素SiO2,炭化ケイ素SiC等
特徴:融点が高い,電気をほとんど導かない,かたい,水に溶けにくい(黒鉛は例外)
11)分子結晶と分子間の相互作用
分子結晶
多数の分子が規則正しく配列してできた結晶を分子結晶という。
分子間の引力(分子間力):
ファンデルワールス力・・・全ての分子間で生じる
水素結合 ・・・ 全ての分子間で生じるわけではない。
特徴:イオン結晶や共有結晶に比べ融点・沸点が低い,電気を導きにくい,柔らかい,昇華するものがある。これは、分子間力がイオン結合や共有結合に比べて、弱い結合であるためである。
結合の強さ ・・・ ファンデルワールス力,水素結合 << イオン結合,共有結合
昇華性がある分子
ドライアイスCO2,ヨウ素I2,ナフタレンC10H8,p-ジクロロベンゼンC6H4Cl2
分子間の相互作用
①ファンデルワールス力
分子間に働く引力で、イオン結合や供給結合よりも弱い結合である。分子量に比例するので、融点・沸点は分子量が大きいほど高くなる。
②水素結合
下のグラフより、H2O,HF,NH3は分子量の割に沸点が著しく高い。
(理由)H2O,HF,NH3分子中のO-H,F-H,N-Hは特に極性が大きく、次のような分子間力より強い水素結合が生じるため、

12)金属結合と金属の結晶
金属結合
金属元素どうしの結合を金属結合という。金属元素は多数の原子が集まって結合し、結晶となっている。金属の原子は一般的にイオン化エネルギーが小さく、価電子を放出して陽イオンになりやすい。金属の原子が多数で結合するときは、まず各金属原子が価電子を放出して陽イオンになる。陽イオンどうしは反発しあうので、直接結合することはないが、放出された電子によって、陽イオンどうしが集まる。この電子は陽イオンの間を自由に動き回ることができる。このような電子を自由電子という。金属の結晶は金属のイオン(陽イオン)が自由電子によって互いに引き合って結合していることになる。つまり、金属の結晶を構成している粒子は陽イオンと電子である。

金属の特徴
金属光沢がある。光に対して不透明で,光を強く反射する。大きな熱伝導性と電気伝導性をもつ。これは、自由電子の移動によって熱や電気のエネルギーが容易に運ばれるからである。
固体の状態で、線に引くことができる延性や箔状にすることができる展性に富む。この性質があるのは、金属の結晶中の陽イオンは自由電子によって引き合っているので、粒子の位置が変わっても互いに引き合う力が変わらないからである。
金属の結晶
金属原子が、金属結合によって規則正しく配列してできた結晶を金属結晶という。その中で規則正しく繰り返されている粒子の配列構造を結晶格子という。金属結晶の構造の主なものは,下図の3種類である。

・体心立方格子

粒子数(単位格子につまった原子の数):2個
配位数(1つの原子に接している他の原子の数):8個
充填率(単位格子中で球が占める体積の割合):68%
・面心立方格子

粒子数:4個 配位数:12 充填率:74%
・六方最密構造 粒子数:6 配位数:12 充填率:74%
13)結晶質と非晶質
結晶構造をもつ固体を結晶質といい、構成粒子(イオン,原子,分子)の配列が規則的で、三次元の構造に周期性がみられる。それに対して、構成粒子の配列に規則性がない固体を非晶質という。非晶質には三次元の構造に周期性がなく、この状態を無定形あるいはアモルファスという。ガラス,アモルファス金属(高温で融解した金属を急激に冷やすと得られる)などがあり,色々な材料として用いられている。
14)結晶の比較
問題
次の結晶に関する表を完成させよ。それぞれの空欄に入る語句を指定された項目より選んで記号で答えよ。ただし、それぞれの物質が結晶化した場合で答えよ。
|
|
構成粒子 |
結合の種類 |
融点 |
電気伝導性 |
機械的性質 |
物質の例 |
|
イオン結晶 |
|
|
|
|
|
|
|
分子結晶 |
|
|
|
|
|
|
|
共有結晶 |
|
|
|
|
|
|
|
金属結晶 |
|
|
|
|
|
|
|
構成粒子 |
①原子 |
②分子 |
③電子 |
④陽イオン |
⑤陰イオン |
|
|
結合の種類 |
①イオン結合 |
②共有結合 |
③金属結合 |
④分子間力 |
|
|
|
融点 |
①高い |
②低い |
③様々 |
|
|
|
|
電気伝導性 |
①良導体 |
②絶縁体 |
③水溶液や融解液にした場合良導体 |
|||
|
機械的性質 |
①強い・硬い |
②延性・展性がある |
③弱い・軟らかい |
④強い・硬い・もろい |
||
|
物質の例 |
①マグネシウム |
②炭酸カルシウム |
③ケイ素 |
④塩化ナトリウ |
⑤ヨウ素 |
|
|
|
⑥カリウム |
⑦ダイヤモンド |
⑧ナフタレン |
|
|
|
|
|
構成粒子 |
結合の種類 |
融点 |
電気伝導性 |
機械的性質 |
物質の例注4) |
|
イオン結晶 |
④ ⑤ |
① |
① |
③ |
④ |
② ④ |
|
分子結晶 |
② |
④ |
② |
② |
③ |
⑤ ⑧ |
|
共有結晶 |
① |
② |
① |
②注2) |
①注3) |
③ ⑦ |
|
金属結晶 |
③ ④ |
③ |
③注1) |
① |
② |
① ⑥ |
注1)水銀は液体の金属であることを考えると、融点が様々であると分かる。
注2),3)黒鉛は例外
注4)
①マグネシウムMgは金属なので、金属結晶。②炭酸カルシウムCaCO3はカルシウムイオンCa2+と炭酸イオンCO32-に分けられるので、イオン結晶。③ケイ素Siは共有結晶。④塩化ナトリウムNaClはナトリウムイオンNa+と塩化物イオンCl-に分けられるので、イオン結晶。⑤ヨウ素I2は非金属からなる分子なので、分子結晶。⑥カリウムKは金属なので、金属結晶。⑦ダイヤモンドは炭素Cからなるので、共有結晶。⑧ナフタレンC10H10はで非金属からなる分子なので、分子結晶。